
盐酸是氢氯酸的俗称,是氯化氢(HCl)气体的水溶液,为无色透明的一元强酸。盐酸具有极强的挥发性,因此打开盛有浓盐酸的容器后能在其上方看到白雾,实际为氯化氢挥发后与空气中的水蒸气结合产生的盐酸小液滴。 盐酸(Hydrochloric acid)分子式HCl,相对分子质量36.46。盐酸为不同浓度的氯化氢水溶液,呈透明无色或黄色,有刺激性气味和强腐蚀性。易溶于水、乙醇、乙醚和油等。浓盐酸为含38%氯化氢的水溶液,相对密度1.19,熔点-112℃沸点-83.7℃。3.6%的盐酸,pH值为0.1。注意盐酸绝不能用以与氯酸钾反应制备氯气,因为会形成易爆的二氧化氯,也根本不能得到纯净的氯气 。
服务承诺:原厂正品 质量保证 诚信经营 信誉**
产品介绍
产品参数
盐酸
Hydrochoricacid
HCl 分子量:36.46
性状:无色透明液体。在空气中发烟。有刺激性酸味。能与水任意混溶。比重:约1.18。有腐蚀性。
运输要求:二级无机酸性腐蚀物品。危规号:93001。
用途:常用分析试剂。氯化物合成。腐蚀剂。
规格:GB622-77优级纯
含量……………………………………………………………………………………………36.0-38.0%
外观…………………………………………………………………………………………………合格
杂质最高含量:
灼烧残渣(盐)……………………………………………………………………………0.0005%
游离盐(Cl2)…………………………………………………………………………………0.00005%
硫酸盐(SO4)…………………………………………………………………………………0.0001%
亚硫酸盐(SO3)………………………………………………………………………………0.0001%
铁(Fe)………………………………………………………………………………………0.00001%
重金属(以Pb计)……………………………………………………………………………0.00005%
砷(As)………………………………………………………………………………………0.000003%
锡(Sn)…………………………………………………………………………………………0.0001%
包装单位:500毫升、2500毫升
盐酸属于危化品
需要预先办理易制毒备案方可购买特此提示
公司荣誉

物理性质
盐酸是无色液体(工业用盐酸会因有杂质三价铁盐而略显黄色),有腐蚀性,为氯化氢的水溶液,具有刺激性气味,一般实验室使用的盐酸为0.1mol/L,pH=1。高中化学把盐酸和硫酸、硝酸、氢溴酸、氢碘酸、高氯酸合称为六大无机强酸。氯化氢与水混溶,浓盐酸溶于水有热量放出。溶于碱液并与碱液发生中和反应。能与任意混溶,氯化氢能溶于苯。由于浓盐酸具有挥发性,挥发出的氯化氢气体与空气中的水蒸气作用形成盐酸小液滴,所以会看到白雾。
化学性质
与酸碱指示剂反应
盐酸遇紫色石蕊试液、pH试纸变红色,遇无色酚酞无明显现象(不变色)。
中和反应
盐酸与碱发生中和反应,生成氯化物和水
HCl+NaOH==NaCl+H2O
2HCl+Ca(OH)2==CaCl2+2H2O
置换反应
盐酸与活泼金属单质反应,生成氢气
Fe+2HCl==FeCl2+H2↑
Zn+2HCl==ZnCl2+H2↑
和碱性氧化物反应
盐酸和碱性氧化物反应,生成盐和水
CuO+2HCl==CuCl2+H2O
MgO+2HCl==MgCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe3O4+8HCl==FeCl2+2FeCl3+4H2O(铁有+2价和+3价)
和盐反应
还原性
2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2↑+8H2O
4HCl(浓)+MnO2====MnCl2+2H2O+Cl2↑
14HCl(浓)+K2Cr2O7==3Cl2↑+2CrCl3+2KCl+7H2O
NaClO+2HCl==NaCl+Cl2↑+H2O(氯元素的归中反应)
另外,盐酸能与硝酸银溶液反应,生成不溶于稀硝酸的氯化银。氯化银难溶于水,产生白色的凝乳状沉淀:
HCl+AgNO3==HNO3+AgCl↓
制取弱酸
CH3COONa+HCl=CH3COOH+NaCl 2HCl+Na2SO3==SO2↑+H2O+2NaCl
应用领域
生活用途
人体用途
人类和其他动物的胃壁上有一种特殊的腺体,能把吃下去的食盐变成盐酸。盐酸是胃液的一种成分(浓度约为0.5%),它能使胃液保持激活胃蛋白酶所需要的最适合的pH值,它还能使食物中的蛋白质变性而易于水解,以及杀死随食物进入胃里的细菌的作用。此外,盐酸进入小肠后,可促进胰液、肠液的分泌以及胆汁的分泌和排放,酸性环境还有助于小肠内铁和钙的吸收。
日常用途
制取洁厕灵、除锈剂等日用品。
工业用途
用于稀有金属的湿法冶金
例如,冶炼钨时,先将白钨矿(钨酸钙矿)与碳酸钠混合,在空气中焙烧(800℃~900℃)生成钨酸钠。
CaWO4+Na2CO3==Na2WO4+CaO+CO2↑
将烧结块浸在90℃的水中,使钨酸钠溶解,并加盐酸酸化,将沉淀下来的钨酸滤出后,再经灼热,生成氧化钨。
Na2WO4+2HCl==H2WO4↓+2NaCl
H2WO4====WO3+H2O↑
最后,将氧化钨在氢气流中灼热,得金属钨。
WO3+3H2====W+3H2O(g)
有机合成
例如,在180℃~200℃的温度并有汞盐(如HgCl2)做催化剂的条件下,氯化氢与乙炔发生加成反应,生成氯乙烯,再在引发剂的作用下,聚合而成聚氯乙烯。
漂染工业
例如,棉布漂白后的酸洗,棉布丝光处理后残留碱的中和,都要用盐酸。在印染过程中,有些染料不溶于水,需用盐酸处理,使成可溶性的盐酸盐,才能应用。
金属加工
例如,钢铁制件的镀前处理,先用烧碱溶液洗涤以除去油污,再用盐酸浸泡;在金属焊接之前,需在焊口涂上一点盐酸等等,都是利用盐酸能溶解金属氧化物这一性质,以去掉锈。这样,才能在金属表面镀得牢,焊得牢。 还可以通过与一些金属(比如:铝)进行溶解反应,以腐蚀的方法达到去除材料的目的。
食品工业
我国《食品添加剂使用卫生标准》(GB2760-2014)规定:使用量按正常生产需要而定。
盐酸用于水解淀粉制造淀粉糖浆。制法为:精制淀粉加水成为淀粉乳,加盐酸使之成为pH值为1.9~2.1的酸性淀粉乳,加热煮沸使淀粉水解,水解完毕加5%碳酸钠进行中和,再经过滤、脱色、浓缩,即得淀粉糖浆。
在制造柑橘罐头时,盐酸用于脱去橘子囊衣。方法为:将去皮的橘瓣置于浓度为0.1%的盐酸中,于30~35℃下放置20min,待果胶水解后取出以流水漂洗,再用0.8%溶液于35~40℃下漂洗20min左右,除去囊衣后再用流水漂洗以除去残留物和碱液。
此外,盐酸还可用作pH值调节剂和淀粉改良剂等,在食品中不得残留,食品最终制成前须除去或中和掉。
例如,制化学酱油时,将蒸煮过的豆饼等原料浸)泡在含有一定量盐酸的溶液中,保持一定温度,盐酸具有催化作用,能促使其中复杂的蛋白质进行水解,经过一定的时间,就生成具有鲜味的氨基酸,再用苛性钠(或用纯碱)中和,即得氨基酸钠。制造味精的原理与此差不多。
无机药品及有机药物的生产
盐酸是一种强酸,它与某些金属、金属氧化物、金属氢氧化物以及大多数金属盐类(如碳酸盐、亚硫酸盐等),都能发生反应,生成盐酸盐。因此,在不少无机药品的生产上要用到盐酸。
在医药上好多有机药物,例如奴佛卡因、盐酸硫胺(维生素B1的制剂)等,也是用盐酸制成的。
郑重承诺
原厂正品 质量保证 信誉第一

产品展示

质检报告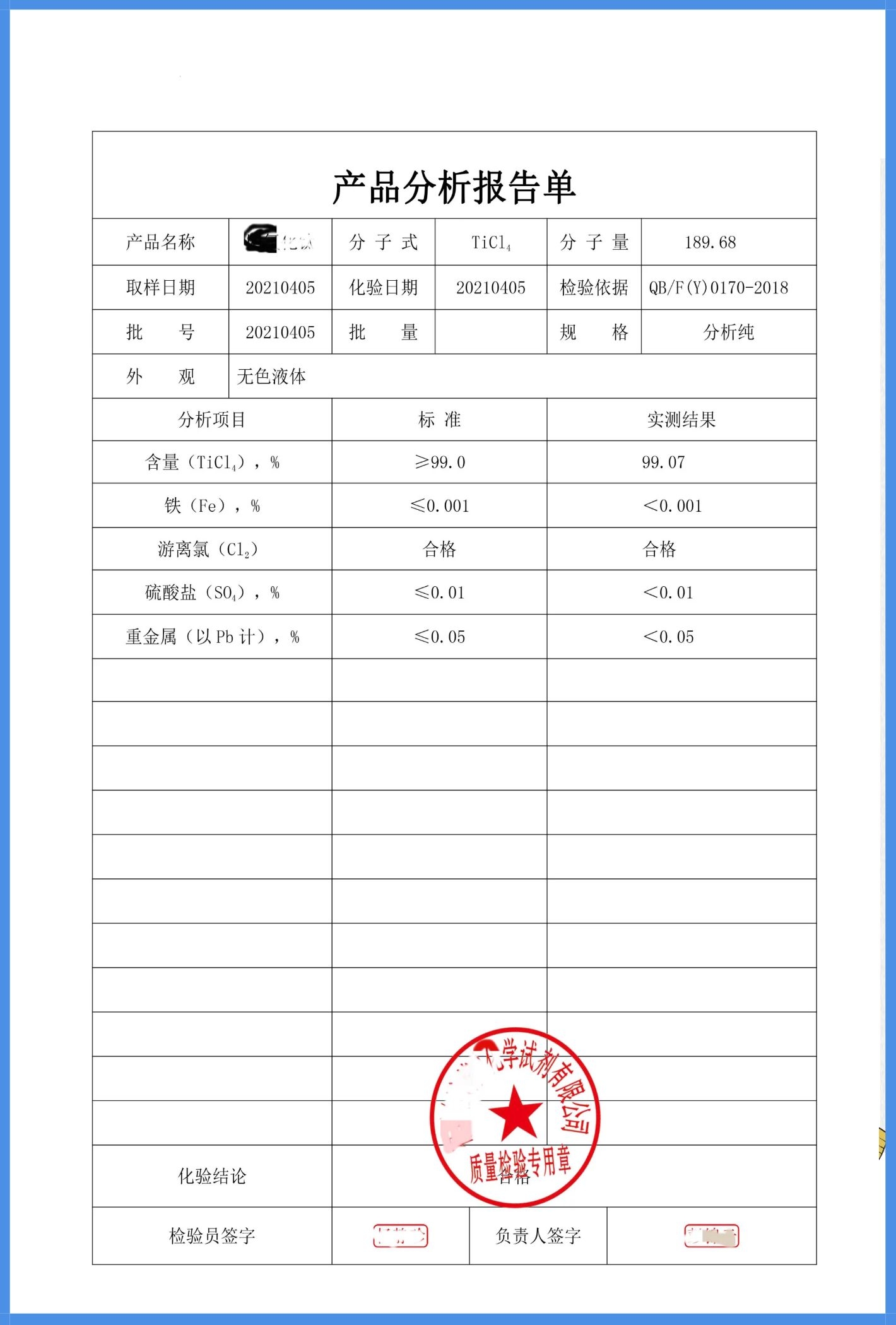
买家必读
物流说明
| 北京 | 全国各地 |
|---|---|
| 小包装快递 | |
| 专车配送 | 大包装专车配送 |
| 大包装统一物流到买家就近的物流点 | 大包装统一物流到买家就近的物流点 |
| 备注:产品包装以出厂包装为准,如有包装要求请与客服销售联系! | |
产品介绍
产品参数
盐酸
Hydrochoricacid
HCl 分子量:36.46
性状:无色透明液体。在空气中发烟。有刺激性酸味。能与水任意混溶。比重:约1.18。有腐蚀性。
运输要求:二级无机酸性腐蚀物品。危规号:93001。
用途:常用分析试剂。氯化物合成。腐蚀剂。
规格:GB622-77优级纯
含量……………………………………………………………………………………………36.0-38.0%
外观…………………………………………………………………………………………………合格
杂质最高含量:
灼烧残渣(盐)……………………………………………………………………………0.0005%
游离盐(Cl2)…………………………………………………………………………………0.00005%
硫酸盐(SO4)…………………………………………………………………………………0.0001%
亚硫酸盐(SO3)………………………………………………………………………………0.0001%
铁(Fe)………………………………………………………………………………………0.00001%
重金属(以Pb计)……………………………………………………………………………0.00005%
砷(As)………………………………………………………………………………………0.000003%
锡(Sn)…………………………………………………………………………………………0.0001%
包装单位:500毫升、2500毫升
盐酸属于危化品
需要预先办理易制毒备案方可购买特此提示
公司荣誉

物理性质
盐酸是无色液体(工业用盐酸会因有杂质三价铁盐而略显黄色),有腐蚀性,为氯化氢的水溶液,具有刺激性气味,一般实验室使用的盐酸为0.1mol/L,pH=1。高中化学把盐酸和硫酸、硝酸、氢溴酸、氢碘酸、高氯酸合称为六大无机强酸。氯化氢与水混溶,浓盐酸溶于水有热量放出。溶于碱液并与碱液发生中和反应。能与任意混溶,氯化氢能溶于苯。由于浓盐酸具有挥发性,挥发出的氯化氢气体与空气中的水蒸气作用形成盐酸小液滴,所以会看到白雾。
化学性质
与酸碱指示剂反应
盐酸遇紫色石蕊试液、pH试纸变红色,遇无色酚酞无明显现象(不变色)。
中和反应
盐酸与碱发生中和反应,生成氯化物和水
HCl+NaOH==NaCl+H2O
2HCl+Ca(OH)2==CaCl2+2H2O
置换反应
盐酸与活泼金属单质反应,生成氢气
Fe+2HCl==FeCl2+H2↑
Zn+2HCl==ZnCl2+H2↑
和碱性氧化物反应
盐酸和碱性氧化物反应,生成盐和水
CuO+2HCl==CuCl2+H2O
MgO+2HCl==MgCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe3O4+8HCl==FeCl2+2FeCl3+4H2O(铁有+2价和+3价)
和盐反应
还原性
2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2↑+8H2O
4HCl(浓)+MnO2====MnCl2+2H2O+Cl2↑
14HCl(浓)+K2Cr2O7==3Cl2↑+2CrCl3+2KCl+7H2O
NaClO+2HCl==NaCl+Cl2↑+H2O(氯元素的归中反应)
另外,盐酸能与硝酸银溶液反应,生成不溶于稀硝酸的氯化银。氯化银难溶于水,产生白色的凝乳状沉淀:
HCl+AgNO3==HNO3+AgCl↓
制取弱酸
CH3COONa+HCl=CH3COOH+NaCl 2HCl+Na2SO3==SO2↑+H2O+2NaCl
应用领域
生活用途
人体用途
人类和其他动物的胃壁上有一种特殊的腺体,能把吃下去的食盐变成盐酸。盐酸是胃液的一种成分(浓度约为0.5%),它能使胃液保持激活胃蛋白酶所需要的最适合的pH值,它还能使食物中的蛋白质变性而易于水解,以及杀死随食物进入胃里的细菌的作用。此外,盐酸进入小肠后,可促进胰液、肠液的分泌以及胆汁的分泌和排放,酸性环境还有助于小肠内铁和钙的吸收。
日常用途
制取洁厕灵、除锈剂等日用品。
工业用途
用于稀有金属的湿法冶金
例如,冶炼钨时,先将白钨矿(钨酸钙矿)与碳酸钠混合,在空气中焙烧(800℃~900℃)生成钨酸钠。
CaWO4+Na2CO3==Na2WO4+CaO+CO2↑
将烧结块浸在90℃的水中,使钨酸钠溶解,并加盐酸酸化,将沉淀下来的钨酸滤出后,再经灼热,生成氧化钨。
Na2WO4+2HCl==H2WO4↓+2NaCl
H2WO4====WO3+H2O↑
最后,将氧化钨在氢气流中灼热,得金属钨。
WO3+3H2====W+3H2O(g)
有机合成
例如,在180℃~200℃的温度并有汞盐(如HgCl2)做催化剂的条件下,氯化氢与乙炔发生加成反应,生成氯乙烯,再在引发剂的作用下,聚合而成聚氯乙烯。
漂染工业
例如,棉布漂白后的酸洗,棉布丝光处理后残留碱的中和,都要用盐酸。在印染过程中,有些染料不溶于水,需用盐酸处理,使成可溶性的盐酸盐,才能应用。
金属加工
例如,钢铁制件的镀前处理,先用烧碱溶液洗涤以除去油污,再用盐酸浸泡;在金属焊接之前,需在焊口涂上一点盐酸等等,都是利用盐酸能溶解金属氧化物这一性质,以去掉锈。这样,才能在金属表面镀得牢,焊得牢。 还可以通过与一些金属(比如:铝)进行溶解反应,以腐蚀的方法达到去除材料的目的。
食品工业
我国《食品添加剂使用卫生标准》(GB2760-2014)规定:使用量按正常生产需要而定。
盐酸用于水解淀粉制造淀粉糖浆。制法为:精制淀粉加水成为淀粉乳,加盐酸使之成为pH值为1.9~2.1的酸性淀粉乳,加热煮沸使淀粉水解,水解完毕加5%碳酸钠进行中和,再经过滤、脱色、浓缩,即得淀粉糖浆。
在制造柑橘罐头时,盐酸用于脱去橘子囊衣。方法为:将去皮的橘瓣置于浓度为0.1%的盐酸中,于30~35℃下放置20min,待果胶水解后取出以流水漂洗,再用0.8%溶液于35~40℃下漂洗20min左右,除去囊衣后再用流水漂洗以除去残留物和碱液。
此外,盐酸还可用作pH值调节剂和淀粉改良剂等,在食品中不得残留,食品最终制成前须除去或中和掉。
例如,制化学酱油时,将蒸煮过的豆饼等原料浸)泡在含有一定量盐酸的溶液中,保持一定温度,盐酸具有催化作用,能促使其中复杂的蛋白质进行水解,经过一定的时间,就生成具有鲜味的氨基酸,再用苛性钠(或用纯碱)中和,即得氨基酸钠。制造味精的原理与此差不多。
无机药品及有机药物的生产
盐酸是一种强酸,它与某些金属、金属氧化物、金属氢氧化物以及大多数金属盐类(如碳酸盐、亚硫酸盐等),都能发生反应,生成盐酸盐。因此,在不少无机药品的生产上要用到盐酸。
在医药上好多有机药物,例如奴佛卡因、盐酸硫胺(维生素B1的制剂)等,也是用盐酸制成的。
郑重承诺
原厂正品 质量保证 信誉第一

产品展示

质检报告
买家必读
物流说明
| 北京 | 全国各地 |
|---|---|
| 小包装快递 | |
| 专车配送 | 大包装专车配送 |
| 大包装统一物流到买家就近的物流点 | 大包装统一物流到买家就近的物流点 |
| 备注:产品包装以出厂包装为准,如有包装要求请与客服销售联系! | |